(Ⅲ) 저선량(低線量) 방사선이 인체(人體)에 주는 영향(2)
(B) 저선량 방사선에 의한 유전성 영향(Heritable effects)
Heritable effects란 부모가 방사선피폭을 받은 후 태어난 후손에서 생기는 효과를 일컫는다. 생식선이나 생식세포에 방사선이 작용하면 유전물질에 손상을 주어 유전적 결함으로 유발되는 질병을 일으킬 수 있다. 이는 노출된 개인의 자녀나 손자에게 기형, 대사장애, 면역결핍 등을 초래할 수 있으며 여러 세대가 지난 후에야 뚜렷이 나타날 가능성도 있다. 암과 마찬가지로 유전병도 방사선노출로 인해 특발적으로 발생되는 것은 불분명하지만 자연적으로 발생하거나 다른 환경적 요인에 의해 발생하는 유전적 질환과 임상양상으로는 구별할 수 없다.
원자폭탄 생존자들은 방사능에 노출된 추적대상 선친 중 가장 큰 그룹이다. 이들 원자폭탄 피폭 선친을 둔 자녀들이 유전적 손상연구 참가자로 등록되어 있으며 현재까지도 정기적으로 방사선의 유전적 영향에 대한 추적검사를 받고 있다.
방사능에 노출되지 않은 일본인구와 비교할 때 지금까지 원폭생존자의 자녀와 손자에게서 통계적으로 유의미한 유전병 빈도의 증가는 관찰되지 않았다. 위험추정을 위해서는 상대적으로 강한 방사선조사에 따른 영향을 동물실험을 통해 조사해야만 하며 현재까지 통계적으로 기록할 수 없었던 저선량 방사선이 인체에 미치는 영향은 이러한 결과로부터 유추해야 한다. 방사선 진단방법 중 컴퓨터단층촬영(CT)이 가장 높은 방사선 노출을 야기한다. 만일 복부CT를 찍는 경우 4mSv의 선량 중 약 0.08mSv의 생식선선량을 유발한다. 국제방사선방호위원회(ICRP)는 부모가 일시적으로 1Sv의 생식선선량에 노출되면 신생아 500명에 한명 비율로 방사선유발 돌연변이에 의한 심각한 질병이 발생한다고 추정한다.
이러한 유전적 위험은 최대 2세대에 걸쳐서 지속될 수 있으며 특히 일시적이 아닌 만성적인 방사선노출은 여러 세대에 걸쳐 유전적 위험이 지속될 수 있다. 이 경우 1Sv의 생식선 선량으로 심각한 질병을 일으키는 추가 돌연변이가 100명의 신생아 출생에서 한명 꼴로 발생한다고 가정하고 있다.
(C) 저선량 방사선에 의한 Hormesis
방사선 호메시스효과(stimulation by the use of a low concentration of a toxin)는 미국 미주리대학 러키(T. D Luckey)교수가 주장한 이론으로 다량의 방사선은 생물체에 피해를 주지만 소량의 방사선은 오히려 생명체의 생리활동을 촉진해 수명이 연장되거나 성장촉진 또는 종양발생률 저하 등 유익한 효과를 준다는 것을 의미한다.
즉 저선량 방사선은 세포기능을 자극하고 증식과 재생능력을 촉진하는 면역학적 반응증진을 야기하여 인체의 자연방어 메커니즘이 향상된다고 한다. 특히 소량의 방사선을 받았을 때는 오히려 암 발생율이 감소하며 인체에 유리한 영향을 미친다는 학설이다.
그 근거로 제시되는 예는,
1. 방사선을 차폐하면 세포에 스트레스가 평소보다 더 증가하고 성장 둔화한다.
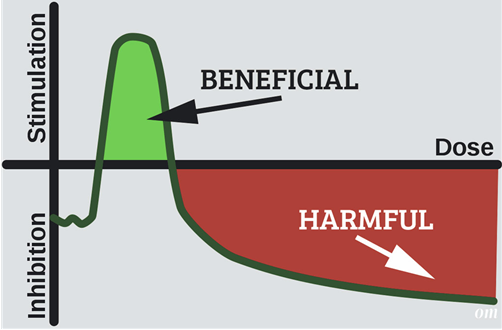
2. 개(비글)를 대조집단과 처치집단을 구분해 전 생애 피폭한 실험에서 저선량 피폭집단이 더 오래 생존한다는 사실이 확인되었다.
3. 일본원폭 생존자 연구에서 저선량 피폭집단이 더 오래 생존하는 것이 통계적으로 입증되었다.
4. 대만의 타이베이 한 아파트 주빈(1만 여명); 1983년부터 1997년까지 연평균 49mSv피폭되었으나 대만 암 사망률은 꾸준히 증가하는 동안 이 아파트에선 암 발생률이 지속적으로 감소했다.
5. 원전 노동자가 더 오래 산다.
6. 자연방사선이 높은 지역 주민이 더 오래 산다.
7. 핵실험 인근 방사능 낙진 피폭지역 주민이 더 오래 산다. 등이다.
그러나 BEIR VII의 보고서에서는 이 모델을 채택하고 있지 않다.
(D) 저선량 방사선의 발암(發癌)유도 가능성
1) LNT model( linear no-threshold model; 선형 무임계값 모델); 방사선 피폭량과 암 발생 위험도가 선형관계를 보이고 암 발생을 위한 문턱선량은 없다고 추정하는 모델이다. 아무리 작은 선량의 방사선이라도 암 발생의 확률이 있으며 이는 방사선의 양과 비례하지만 역치는 없다고 가정한다.
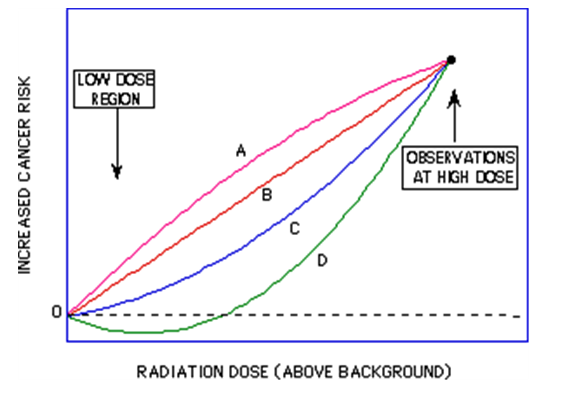
BEIR VII 보고서(Health Risks from Exposure to Low Levels of Ionizing Radiation)에서는 고형암의 발생위험이 이 모델을 따른다고 가정하였다.
2) Linear quadratic model; 방사선 피폭량이 증가함에 따라 암 발생의 위험도도 증가하나 좀 더 완만한 관계를 보이는 모델이다. BEIR VII 보고서에서는 백혈병의 발생위험이 이 모델을 따른다고 추정하였다.
3) Linear model with a threshold; 어떤 문턱값이 존재하여 그 이하에서는 암 발생이 증가하지 않지만 이 값을 넘어서는 피폭을 받을 때에는 암 발생 위험도가 방사선 피폭 량에 비례하여 증가한다는 모델이다.
원폭생존자들을 대상으로 한 연구에서 암 발생 비율은 일시적인 100mSv 이상의 피폭생존자에게서 의미 있게 증가하였다. 하지만 특수한 상황이 아니면 보통사람이 100mSv 이상의 방사선에 피폭되는 경우는 매우 드물며, CT 촬영에서와 같이 저선량 방사선 피폭에서 방사선 피폭과 암의 관계를 추적하는 것이 중요하다. 100mSv 이하에서 선량을 조사받은 그룹에서 암 발생위험도를 추정하기 위해서는 알려진 데이터(100mSv 이상에서의 암 발생률)를 이용한 외삽(外揷; extrapolation)이 필요하다.
따라서 대부분 저선량 영역에서의 암 발생은 고선량에서의 자료에 외삽하여 암 발생 위험도를 추정한다. 즉 0.01Sv당 생애 암 위험이 5/10,000라면 통계적으로 충분히 신뢰성 있는 자료를 얻기 위해서는 아마도 0.01Sv 정도의 피폭을 받는 집단이 100,000명 정도(예상 암 치사자수 50명) 있어야 하고 이들을 수십 년 동안 추적해야 한다. 그런데 자연적인 암 치사율이 대개 20% 정도이므로 그 집단 십만 명 중 20,000명 안팎이 자연적 암에 의해 사망할 것으로 예상되고 있다. 여기서 20,000명 안팎이란 18,000명이 될 수도 있고 21,000명이 될 수도 있다는 뜻이므로 저선량의 방사선피폭으로 인한 초과 사망자 수(기대치) 50명은 자연 암 치사의 통계적 오차와 구분되기 어려워진다.
또한 암 발생은 세포 안에 있는 유전자에 일어난 변화로 시작되어 몇 년 또는 몇 십 년이라는 잠복기를 거쳐 발현하므로 추적과 통계작성에 큰 어려움이 있으나 결론적으로 가장 중요한 사안은 저선량 피폭에 의한 지연성 발암가능성이 존재하는가 하는 것이다. 하지만 아직도 이에 대해 명확한 과학적 근거를 도출하지 못하고 있는 이유는 다음과 같다.
① 방사선으로 인해 생기는 특유의 암은 존재하지 않는다.
예를 들어 폐암의 원인에 대해 폐에 병이 있거나 객담에서 결핵균이 검출되면 결핵균에 의한 병이라고 진단할 수 있고 병소조직에는 결핵 특유의 병리소견이 있을 수 있으므로 폐암이 발견되어도 그 폐암이 방사선에 의한 것인지, 담배에 의한 것인지, 또는 기타 원인에 의한 것인지는 알 수 없다. 많은 질환에서는 병소조직에서 원인을 찾을 수 있지만 암의 경우는 불가능하다.
② 통계학적으로 유의차를 나타내는 것이 곤란하다
방사선에 의한 발암과 다른 원인에 의한 발암을 구별할 수 없으므로 통계학(역학)적으로 차이가 있는가를 나타내야 한다. 예를 들어 방사선을 40~60mSv 받은 군과 10mSv 이하의 군을 비교해서 발암율에 유의한 차가 있는지를 통계학(역학)적으로 나타내야 한다. 하지만 저선량 피폭에서는 선량에 따른 발암률의 차이가 지극히 작기 때문에 모수가 작은 경우에는 우연일 지도 모르는 몇 명의 발암이 결과에 큰 영향을 주는 위험성이 있다는 것이다.

글_ 김영진 박사
전 건강보험심사평가원 상근 심사위원
대한치의학회 고문 역임
제 23회 ‘치과의료문화상’ 수상
제 30회 보건의 날 ‘대한민국국민포장’ 수훈

