임상뼈 생물학의 핵심
본지는 지난호부터 12회에 걸쳐 권경환 교수의 임상원고를 게재하려고 한다. 임플란트식립과 악교정 및 안면성형수술을 하면서 치과임상에서 뼈의 중요성은 점점 더 증가하고 있다. 따라서 임상적인 입장에서 뼈 생물학을 다시 돌아보는 기회를 갖고자 한다. 또한, 뼈의 구조와 뼈의 세포학적인 내용과 뼈 성장인자에 대한 내용 등을 함께 정리하는 기회로 마련코자 한다. (편집자주)
10. 골이식술의 핵심: rhBMP-2 LFA collagen scaffold
(1) BMP에 대한 역사와 효능
동종골을 채취하여 같은 종류의 동물에 이식했을 경우 뼈 활성화가 증대되고 특히 동종골을 재처리 과정을 거쳐서 얻은 뼈를 근육내에 주입했을 때 골화반응이 나타나는 것을 정형외과의사이자 생리학자인 Dr. Marshall Urist가 실험적으로 보고하고 이러한 현상을 일으키는 물질을 bone morphogenetic protein이라고 명명한 바 있다(Figure 10-1(1)-(3)).
chaotropic agents를 이용하여 뼈의 유기 성분으로부터 단백질을 추출해 이러한 단백질이 뼈 형성에 중요한 역할을 하는 것으로 밝힌 바 있다. 이러한 단백질을 이식하면 골형성 복합체가 생성되게 된다.
즉, 간엽 세포 침윤, 연골 형성, 혈관 형성, 뼈 형성 및 궁극적으로 조혈 골수 요소에 의한 개체군과 함께 새로운 뼈 조직의 개조를 포함한 일련의 세포 재생과정이 발생하게 된다.
상피뿐만 아니라 뼈 세포주를 비롯한 다른 조직 유형이 유사한 골 유도 활성을 생성하는 것으로 관찰된다. 그러나 이러한 골형성단백질은 지속적으로 1주간과 3주간에 적절한 역할을 하기 때문에 최대 3주간 일정한 장소에서 지속적으로 유지하고 분비돼야 골형성의 과정을 완성할 수 있다.
rhBMP-2는 3주간에 걸쳐서 다양한 작용을 하게 된다.
1주째에는 neovasculization을 일으키며 이러한 현상은 임상에서는 ecchymosis와 swelling으로 나타나기 때문에 임상부작용중 가장 큰 문제로 대두되고 있다.
신생혈관화가 이루어지지 않고 골형성시 영양공급이나 세포이동의 통로가 마련되지 않기 때문에 향후 osteon의 형성이나 재생과정의 골세포의 활성도를 높일 수 없게 된다.
2주째에는 chemotaxis(화학주성)를 일으키게 된다. 주변의 미분화세포의 이동과 골모세포의 이동을 촉진하게 된다. 이러한 촉진경로로는 골수의 collagen fiber를 통해서 이동하게 된다. 이러한 collagen fiber의 풍부한 상태에서 화학주성이 일어나게 된다.
3주째에는 differentiation and proliferation이 일어나게 된다. 미분화세포의 분화가 일어나고 주변에서 성숙과정을 거쳐서 osteon의 역할을 할수 있는 골모세포의 calcification을 일으키는 역할을 하는 것이 rhBMP-2의 역할이다.

(2) Collagen fibers
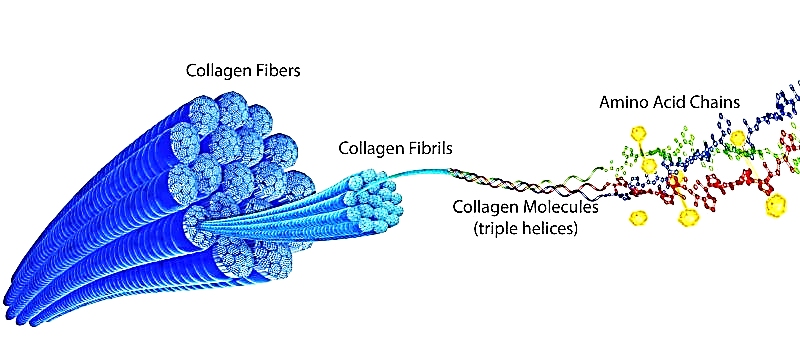
콜라겐섬유는 백색이기 때문에 콜라겐이 풍부한 조직은 당연히 백색을 띤다. 재구성의 시기인 콜라겐 섬유 ‘회전주기(turnover)’는 정상적으로 300-500일 정도이다. 뼈를 형성하는 성분중 무기질과 유기질이 있으며 유기질 중에서 80%이상을 차지하는 것이 콜라겐섬유이다. 수분 다음으로 콜라겐은 결합조직의 두 번째로 많은 구성요소이다. 그것은 전체 신체 단백질의 거의 30%를 차지한다. 28개의 콜라겐 형태가 지금가지 확인되고 있으며 이중 가장 중요한 유형이 유형 I, II, III그리고 IV이다. 이 네 개의 유형이 전체 콜라겐의 약 95%를 차지하며 이 중 Type I 콜라겐은 대략 80%를 차지한다.
콜라겐은 기본적으로 세 개의 긴 단백질 사슬로 이루어지며(폴리펩타이드), 각각은 좌측 회전된 나선형의 형태인 ‘알파 나선형(alpha helix)’으로 묘사된다. 이 세 개의 나선형 폴리펩타이드는 이어서 함께 우측 방향으로 나선형으로 꼬이며, 삼중의 나선형을 구성한다. 이것이 진정한 코라겐 분자이다. 만약 이것이 세포내부에 있다면 그것은 ‘트로포콜라겐 분자(tropocollagenic molecule)’라고 불린다. 이것은 세포질 세망(endoplasmic reticullum)안에서도 찾을 수 있으며, 약 28nm의 길이와 약 1.5nm의 직경을 보인다(Figure 10-2(1), 10-2(2))

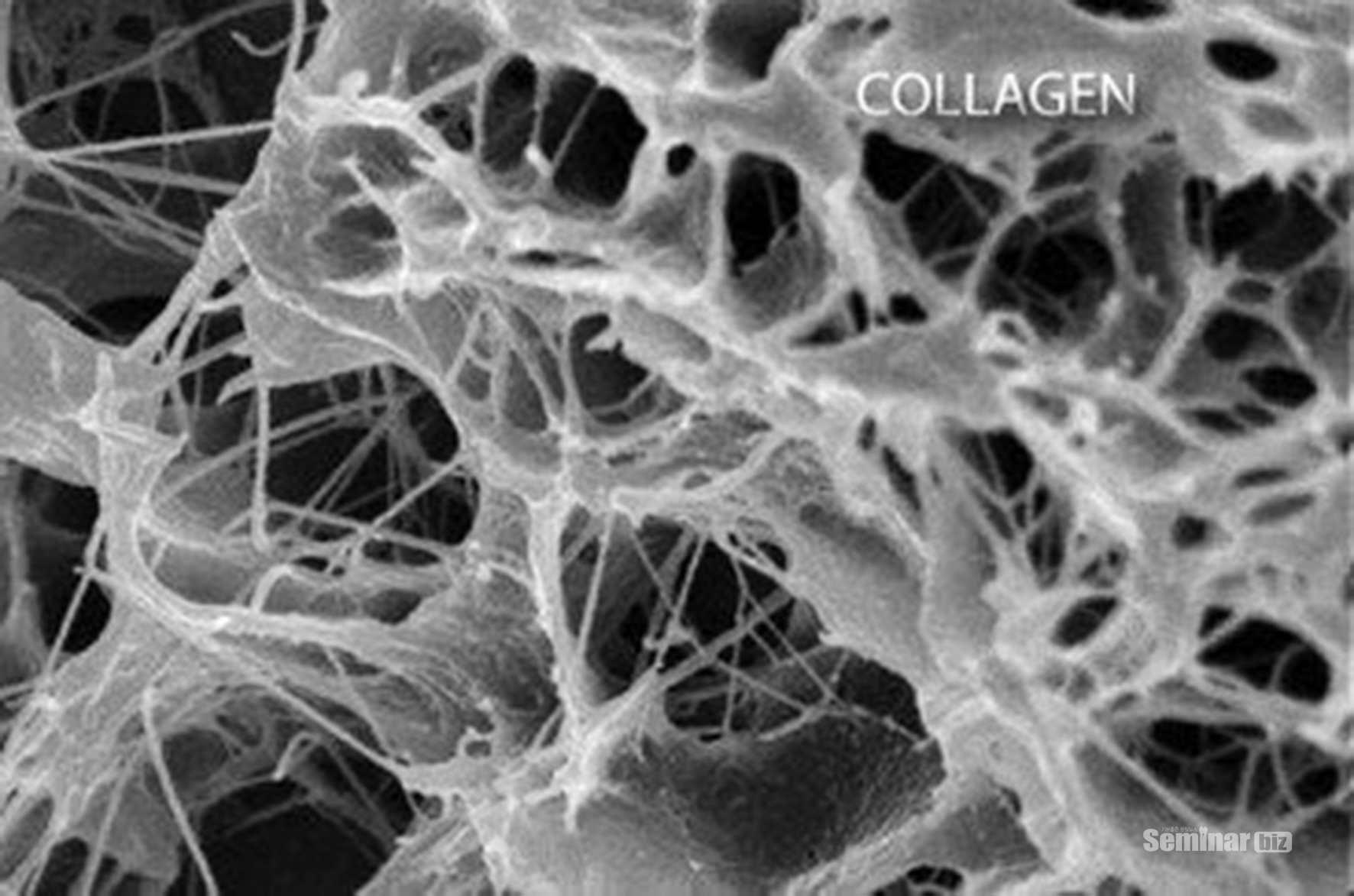
콜라겐은 섬유들간의 서로 꼬이며 원섬유의 다발을 형성하게 된다. 이러한 교차 연결의 발생은 특정 아미노산의 생화학적 연결의 결과이며 그것의 형성을 위하여 비타민 C는 가장 중요한 성분중의 하나이다. 콜라겐의 교차결합을 유지하기 위해선 비타민 C의 섭취가 무엇보다 중요하며 골형성과 근육형성시에 탄력강도를 얻기 위해서는 비타민C의 섭취가 중요하며 면역적인 부분 강화를 위해서는 비타민 D의 섭취가 중요하다.
골세포 및 근육세포들은 여러 가지 단백질 신호를 받아서 새로운 기질의 구성요소를 지속적으로 합성하도록 자극받는다. 결국 인체내의 골세포의 기질을 생산하는데 중요 역할을 하는 단백질이 콜라겐이며 이러한 콜라겐의 골세포에게는 집과 같은 존재로 작용하게 된다.
(3) Fibrinogen
피브리노겐 ( 요소 I )은 혈전 형성에 도움이 되는 척추 동물의 당 단백질이다. 직경이 8 ~ 15 옹스트롬 (Å) 인 것으로 추정되는 매우 얇은 실에 의해 결합된 3 개의 결절의 선형 배열로 구성된다 2 개의 끝 결절은 비슷하지만 중앙의 결절은 약간 작다. 건조된 분자의 길이는 475 ± 25Å이다. 피브리노겐 분자는 용해성 크고 복잡한 340 kDa 혈장 당 단백질 로 혈전 형성 중에는 트롬빈에 의해 피브린으로 변환된다. 9 × 47.5 × 6 nm 크기의 막대 모양이며, 생리적 pH (IP 5.2에서 IP)에서 음의 순 전하를 나타낸다. 섬유소원은 간세포에 의해 간 에서 합성된다, 2011 년의 연구에 따르면 fibrin은 류마티스성 관절염의 염증 반응과 발달에 중요한 역할을 하는 것으로 나타났다. 치유반응은 감염반응과 비슷과 과정을 거치게 되는데 초기 2주간의 경우에는 이러한 현상은 구분하기 어렵게 나타난다. 피브리노겐은 혈액내의 트롬빈의 영향을 받아 피브린으로 변화하게 되면서 주변조직과 경계면을 이루게 하면서 염증성 증상인 혈관 촉진현상이 나타나고 안정적인 고정력을 얻도록 하는 역할을 한다. 이에 골이식재의 이용시 피브리노겐 성분의 첨가로 인하여 다양한 임상적 이득을 얻을 수 있게 된다(Figure 10-3).

다음 호에 계속 ▶

