임상뼈생물학의 핵심
본지는 지난호부터 12회에 걸쳐 권경환 교수의 임상원고를 게재하려고 한다. 임플란트식립과 악교정 및 안면성형수술을 하면서 치과임상에서 뼈의 중요성은 점점 더 증가하고 있다. 따라서 임상적인 입장에서 뼈 생물학을 다시 돌아보는 기회를 갖고자 한다. 또한, 뼈의 구조와 뼈의 세포학적인 내용과 뼈 성장인자에 대한 내용 등을 함께 정리하는 기회로 마련코자 한다. (편집자주)
6. Bone regeneration
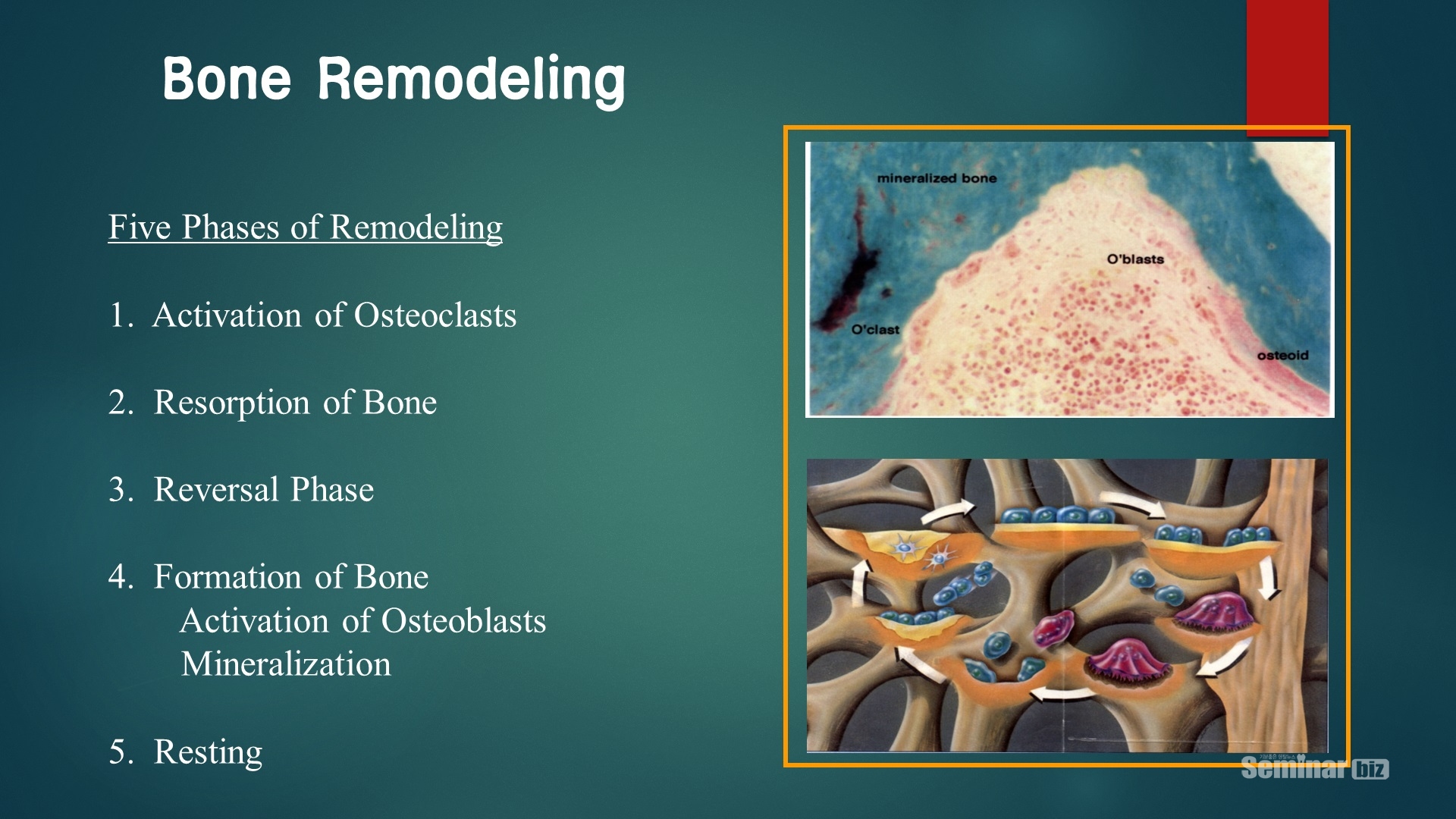
뼈는 뼈 세포, 혈액 및 신경을 포함하는 광물화 된 세포 등과 주변 매트릭스를 포함하는 매우 역동적인 조직이다. 뼈는 세 가지 주요 뼈 특이적 세포 유형을 포함한다. : osteocyte는 뼈대에 앉아서 긴 세포 과정을 통해 다른 osteocytes와 네트워크를 형성하고 뼈의 기계적 스트레스를 감지하며, 기계적 스트레스의 결과로 뼈 개조를 위한 신호를 전송하는 성숙한 세포역할을 한다. 신호에 반응하는 세포는 골아세포(osteoblast, 骨母세포)이며, 골격 내에 독특한 콜라겐이 풍부한 세포 외 기질을 분비하는 세포로 광물화를 가능하게 한다. 세 번째 뼈 세포인 파골 세포(Osteoclast)는 지방화된 산성화 (미네랄 제거) 및 프로테아제 분비 (매트릭스 분해)의 조합을 통해 골 구조를 분해시키는 대식세포 유사 세포. 파골 세포는 뼈를 관통하고 대개 골아 세포와 연관된 네트워크를 가지고 있다. 뼈는 건강한 사람들에게 끊임없이 리모델링된다. 특히 골아세포와 파골세포간의 네트워크와 단백질 분자의 교류등을 통하여 골재생을 일으키게 되고 이러한 골재생은 60일을 기준으로 지속적으로 일어나게 된다(Figure 6-1)

1) Induction of bone by use of BMPs
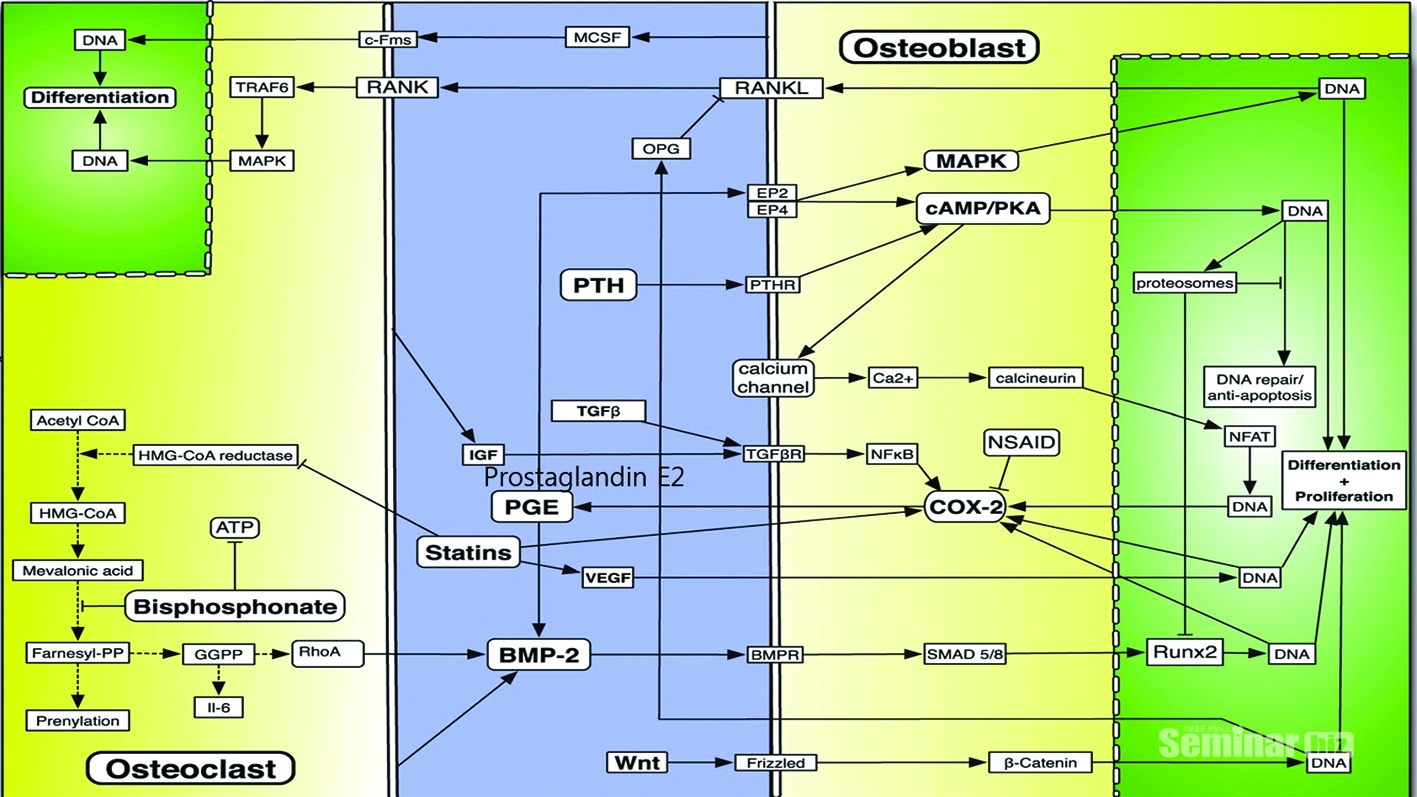
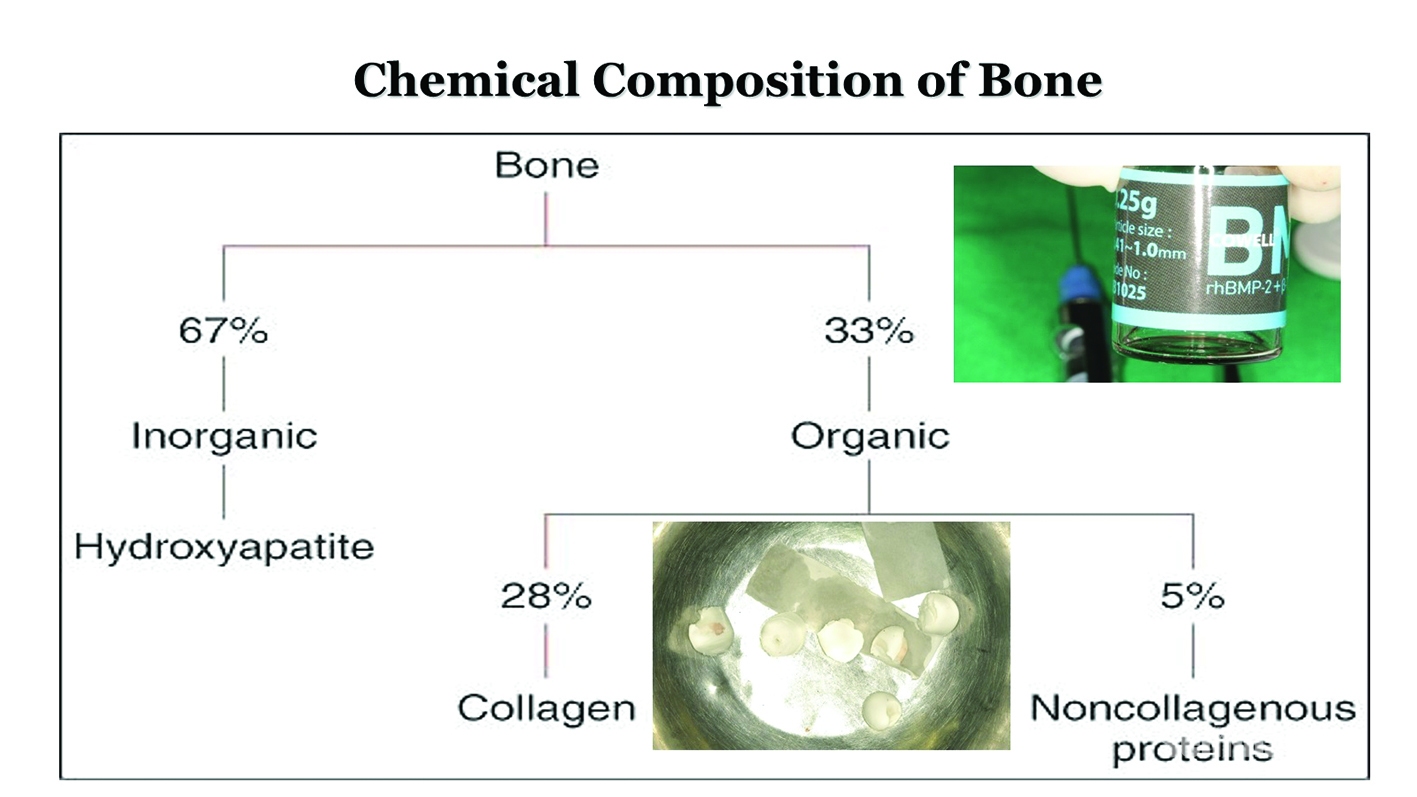
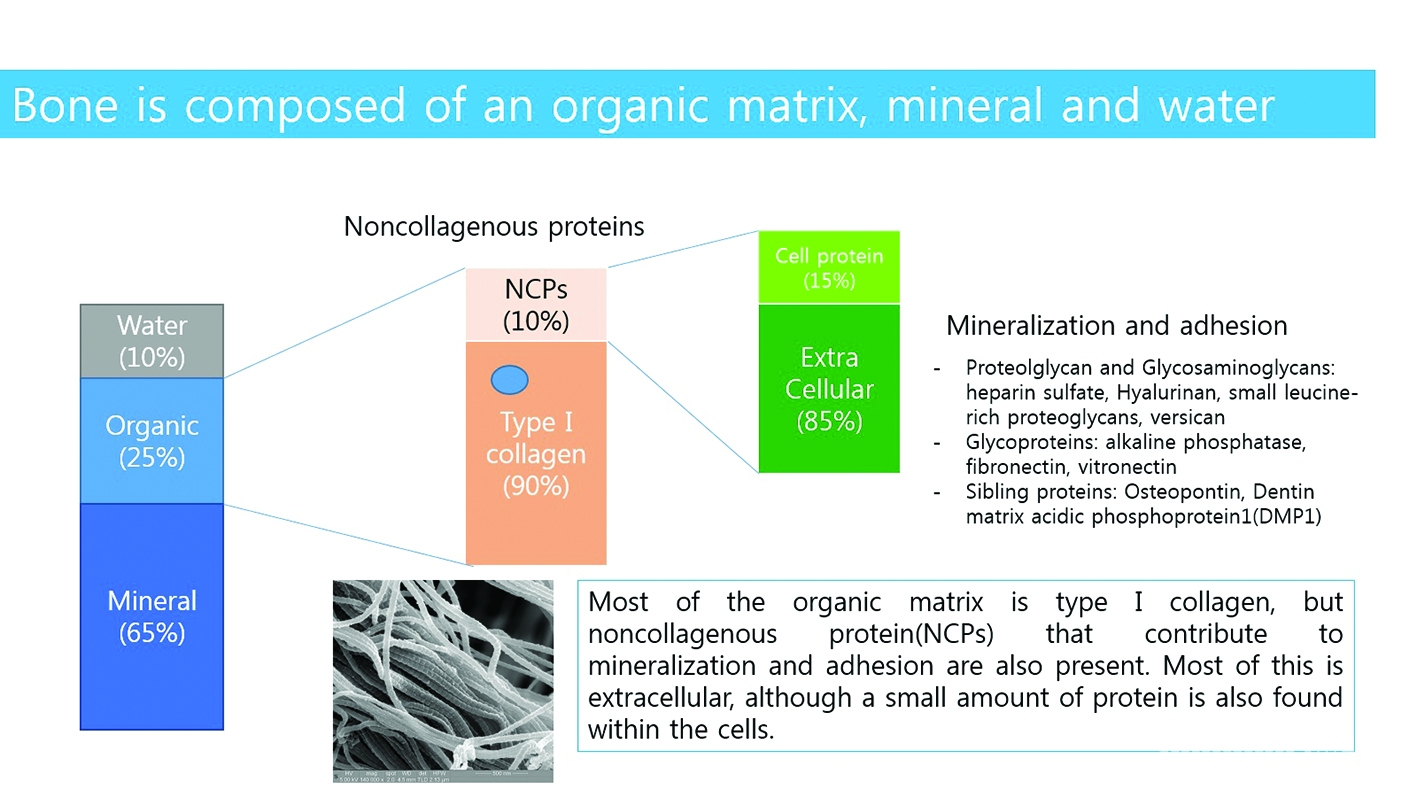
뼈의 건조 중량은 70 %의 무기 물질과 30 %의 유기 물질로 이루어져 있다(Figure 6-2). 유기물의 90 %는 I 형 콜라겐이며 나머지 10 %는 재생을 위해 무기화와 신호를 유도하는 단백질로 구성되어 있다. 1960 년대에, Urist는 탈염 된 뼈 (즉, 무기 성분을 용해시키기 위해 산에 노출 된 뼈, 즉 유기 매트릭스 = 탈회 골격 또는 DBM)이 연골 내피 과정을 통해 이소성(ectopic) 뼈 형성을 유도 할 수 있음을 보여주었다. [참고 이소성 = 일반적인 생리학적 위치가 아닌 모든 부위] DBM에는 확산성 요인이 존재한다고 가정되었다. DBM의 특성에 대한 특성 규명은 분자를 유도하고 유도 할 수 있는 분자 (현재는 BMP-2라고 불림)의 식별 및 복제를 유도했다. 특히 BMP-2의 경우 neovascularization(1주), chemotaxis(2주), differenciation and proliferation(3주)를 순차적으로 돕게 되며 3주간 BMP-2의 역할이 충실하게 진행된다면 양질의 골질을 얻을 수 있게 된다(Figure 6-3). BMP-2가 3주간 유지될수 있고 지속적인 분비를 서방형 형태로 분비할 수 있는 scaffold의 개발이 BMP-2의 역할을 할 수 있도록 하는 최선의 방법이다. 최근 필자가 소개한 바 있는 rhBMP-2 LFA collagen scaffold는 rhBMP-2와 함께 Lidocaine, Fibrinogen, Aprotinin을 포함한 collagen액상은 BMP-2의 역할을 3주간 유지하고 난 다음 완전한 흡수를 일으키면서 주변의 osteoblast와 osteoclast를 화학주성을 일으키면서 neovascularization을 장기적으로 일으키는 역할을 한다. 비콜라겐성 단백질은 유기질 중 10-20%를 차지하고 있으며 osteocalcin과 osteonectin이 구성되어 있다(Figure 6-3). 이런한 비콜라겐성 단백질은 세포의 부착력(osteoblast의 부착력)과 광화작용에 커다란 역할을 담당하고 있다.
2) Use of Bone Progenitor Cells in Bone Tissue Engineering
Osteoclast의 활성도를 악화시키는 약물을 복용하거나 주사제를 맞고 있는 경우, 골치유과정에서 미분화세포의 골화세포로 유도하거나 증식하는 역할을 하지 못하기 때문에 골치유기전에 커다란 문제를 일으키게 된다. 골치유시에는 3가지 주요한 요소가 있는데 첫 번째가 bone progenitor cells의 분화 이고 두 번째는 cytokine으로 골형성단백질 등 성장인자의 분비, 세 번째로는 scaffold인 비계가 성장인자 및 골 치유 미분화세포가 3주이상 존재가능하도록 하는 capsule역할을 하는 요소로 이루어져 있다.
3) 골 치유의 과정(골절치유과정)
치유과정은 염증기, 복원기, 재형성기 등으로 구분되며 염증기의 말기와 복원기의 초기, 복원기의 말기와 재형성기의 초기는 얼마간 서로 중복된다(Figure 6-4).
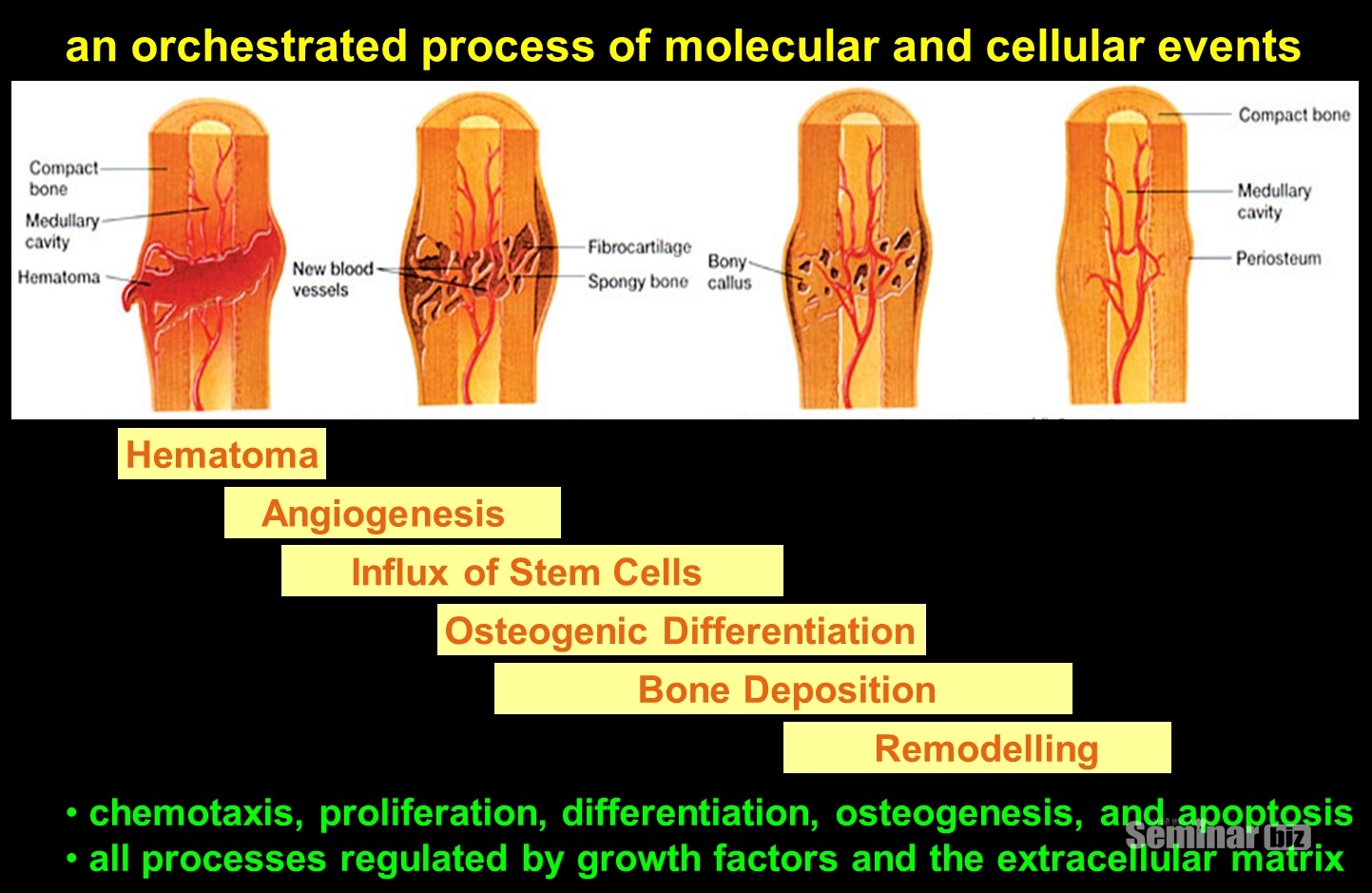
(1) 염증기(inflammatory phase): 골절 후나 골 염증손상 후 연부조직 손상과 혈관, 골기질 내의 세포, 골절부의 골막 손상 등으로 인해 혈종이 형성되고 혈종이 응고되어 응혈 괴사된다. 이 때문에 골세포들이 영향을 공급받지 못해 괴사조직이 된다. 시간이 지나면 혈종 중에 대식세포가 침투하여 괴사조직을 깨끗하게 하는데 이 과정까지 염증이라 한다. Osteoclast의 초기 활동이 증강되는 시기이며 이 시기에 osteoclast의 역할이 주요한 역할을 하게 되는데 IL-1, IL-6의 발현을 통해 주변 골세포의 유주와 분화를 촉진하게 된다.
(2) 복원기(Reparative phase): 육아조직이 응혈괴에 침입하여 기질화를 일으키는 시기로 기질화된 조직들이 골절단을 서로 연결한다. 첫 몇 주일동안은 가골이 골절부위를 감싸는데 초기에는 액성을 나타내다 점점 굳어진다. 이렇게 하여 가동성이 적어지면 혈액 공급이 원활해지고 골막부위에서 골원성 조직내에 신생골이 생기게 된다. 또 혈액공급이 불충분하고 가동성이 많은 부위에서는 먼저 연골을 형성하고 연골내 골화를 거쳐 골로 전환된다. 이러한 현상은 임플란트를 식립하고 임플란트 표면주변에서 발생하는 골절치유과정과 비슷한 과정을 거치게 된다. 가골이 골절부의 가동성을 완전히 제거된 상태를 유합이라고 하며 임상적인 유합은 정상적인 뼈의 강도로는 회복되지 않은 상태를 말한다. Osseointegration의 경우에도 마찬가지로 6-8주까지는 이차 가골이 형성되면서 calcification이 증가하는 단계이다.
(3) 재형성기(Remodeling phase): 회복기에 형성된 가골이 성숙층 판성골로 전환되면서 파골세포가 출현하여 형성된 가골을 흡수한다. 이처럼 미성숙골과 연골이 성숙층판설골로 완전히 바뀌고 골수강이 새로 형성된 상태를 골질화 또는 방사선적 골유합이라 한다. 골수염이나 비스포스포네이트 관련 골괴사증에서 발생하는 염증성 가골이 흡수되지 않으면 골치유 양상인 osteon이나 marrow의 trabecular pattern을 보이기 어렵게 된다. 특히 약물성 골괴사증의 경우에는 파골세포의 활성도가 떨어지면서 염증성 가골의 흡수가 어렵게 되고 이러한 가골은 다시 염증성화를 유발하게된다. 그래서 일차적인 수술을 통해서 치료가 되지 않고 지속적으로 재발소견을 보이게 되는 것이다(Figure 6-5).
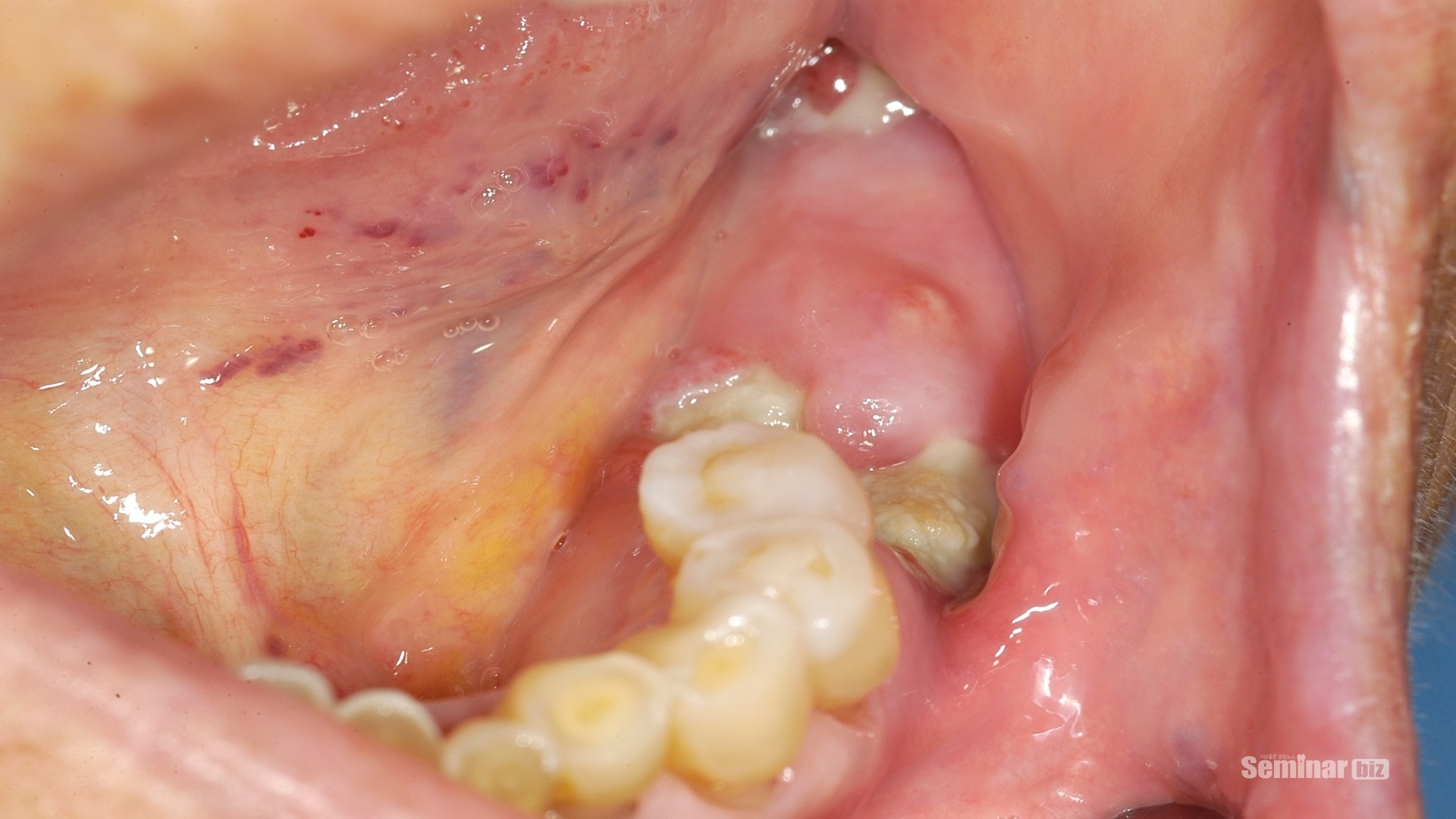
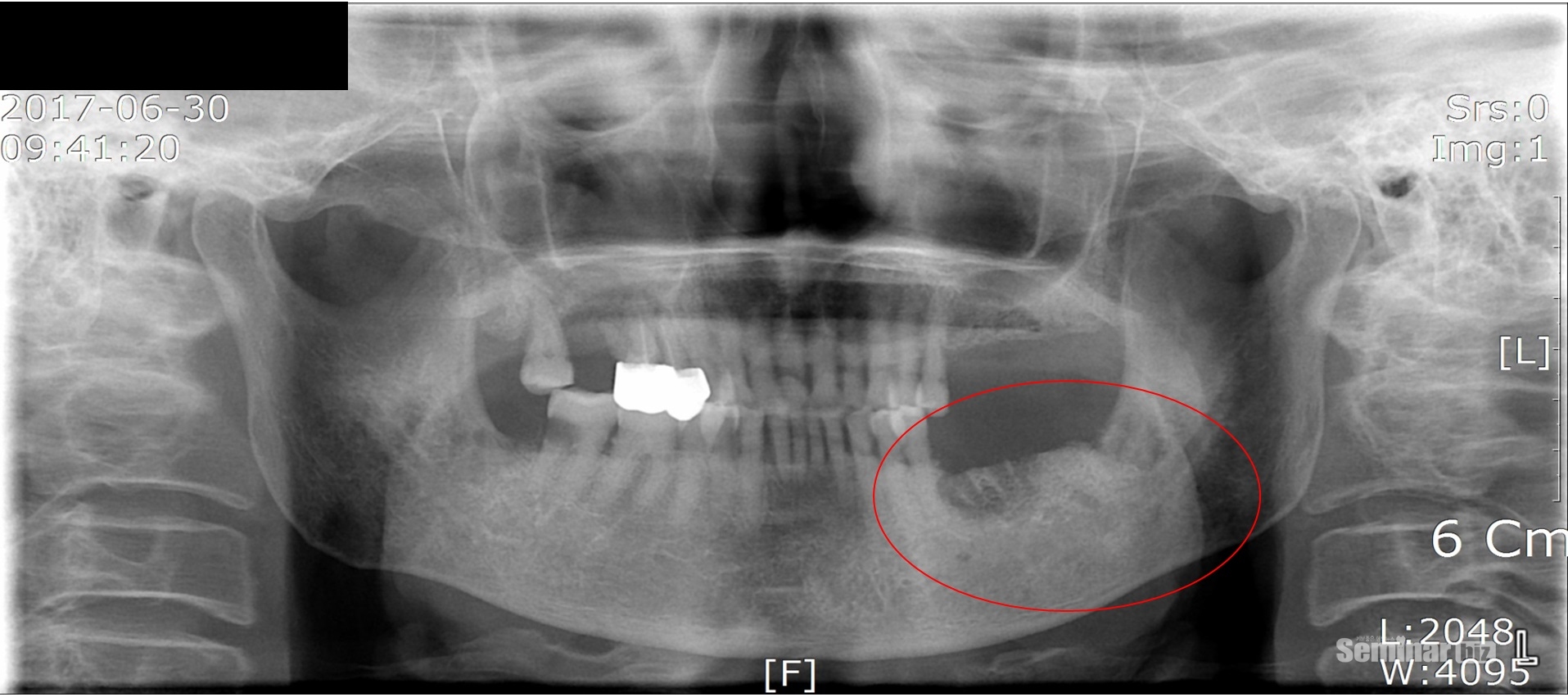
4) Chronic osteomyelitis와 BRONJ(Bisphosphonate related osteonecrosis of Jaws)의 비교
Tae-Geon Kwon 등이 보고한 “Comparison of chronic osteomyelitis versus bisphosphonate-related osteonecrosis of the jaws in female patients without malignant bone disease” 저널에서 BRONJ(Bisphosphonate related osteonecrosis of Jaws)와 COMJ(chronic osteomyelitis of the jaws)의 임상적 차이는 뼈 노출 (각각 100 %와 16 %)이라고 보고된 바 있다(Figure 6-5(1),(2)). BRONJ는 COMJ보다 더 많은 골 용해성 및 침윤성 소견을 보였다 (p <0.05). BRONJ와 COMJ의 방사선 소견에 따른 뼈 핵의학적 소견은 비슷한 양상을 보였다. 대부분의 BRONJ (91.9 %)와 COMJ (94.6 %) 환자에서 증가된 조골 세포 활동 패턴을 반영하는 양성 방사성 동위 원소 섭취가 존재했다. BRONJ의 중요한 임상 적 발견 인 뼈의 노출은 뼈의 병태 생리학적 상태에 영향을 줄 수 있으며, BRONJ의 인접 구조물의 COMJ보다 더 진전된 방사선학적 뼈 파괴 및 관련을 설명 할 수 있다. COMJ와 BRONJ 병변 모두에서 방사능 추적자 섭취가 증가하는 이유는 BRONJ 병변이 '동결(중지) frozon'되어 있지 않으며 골 병변의 염증 반응에 대한 공통적인 증상이 발견되고 있다는 의미이기도 하다. 이와 같이 만성골수염과 약물성 골괴사증간의 방사선학적인 병변을 구분하기 어려지만 파괴양상과 임상적인 뼈의 노출정도, 약물 복용여부가 가장 주요하게 구분하는 방법이라고 할 수 있다.